近日,国内首个用于肠癌无创早筛的产品“常卫清”获得国家药品监督管理局批准上市(注册人名称:杭州诺辉健康科技有限公司),立刻引起了行业的广泛关注。
常卫清是中国第一个使用多靶点粪便FIT-DNA技术,检测粪便样本中与肠癌发生有密切关系的多种DNA和蛋白的分子指标(包括基因突变、基因甲基化变异和血红蛋白),来综合判断受检者患肠道癌前病变(主要为进展期腺瘤)及肠癌风险的筛查产品。
该产品所属的肠癌分子诊断领域近几年竞争非常激烈。此前已经有多个其他厂家的产品进行了注册,例如深圳晋百慧的“miR-92a检测试剂盒”、康立明的“SDC2甲基化检测试剂盒”、博尔诚的“Septin9甲基化检测试剂盒”等。这些产品被药监局批准的预期用途都是“辅助诊断”,但是常卫清选择了“筛查”这样一条跟之前做法大不相同的应用路径。
抛开其他,接下来我们仅从药监局公开的常卫清审评报告,并结合此前药监局公开的其他辅助诊断类产品审评报告,以对比的方式来分析早筛产品的审批特点。不当之处,敬请指正。
一、产品预期用途
常卫清是一个商品名,它正式的产品名称是:
KRAS基因突变及 BMP3/NDRG4 基因甲基化和便隐血联合检测试剂盒(PCR荧光探针法-胶体金法)
这可能是目前我见过的名字最长的体外诊断试剂产品了。从名字里我们大概看出这是一款4个靶标联合检测的试剂盒,使用荧光PCR法检测3个分子标志物,使用胶体金法检测便隐血。

产品获批的预期用途如下:
本试剂盒用于体外定性检测人粪便样本中的KRAS基因突变(包括但不区分 G12D、G12A、G12V、G12S、G12R、 G12C、G13D)、BMP3 和 NDRG4 基因甲基化及血红蛋白,各个指标的检测值通过“KRAS 基因突变及 BMP3/NDRG4 基因甲基化和便隐血联合检测分析软件”计算综合评分,用于对肠镜依从性差的结直肠癌高风险人群的筛查。
综合评分大于或等于阳性判断值的样本为阳性,表示受检者体内可能有结直肠癌和/或进展期腺瘤,需要进一步接受肠镜检查;反之,如果综合评分低于阳性判断值,表示受检者体内有结直肠癌和/或进展期腺瘤的可能性低,但并不能完全排除疾病风险。鉴于受试者为高风险人群,因此在必要时仍应建议进行肠镜检查。
该产品适用人群为年龄40-74岁的结直肠癌高风险人群(高风险人群判定参照中国结直肠肿瘤早诊筛查相关专家共识)。本产品不能替代肠镜,不能用于普通人群的肿瘤筛查,临床诊断过程中不应以本产品检测结果作为临床诊断的唯一依据。
为了更加深入的对这一款产品进行了解,我们简单地选择了另一款同样由NMPA公开审评报告的肠癌辅助诊断分子检测产品-康立明的“人类SDC2 基因甲基化检测试剂盒(荧光PCR法)”,商品名“长安心”,将其二者进行对比,看看有哪些差异。
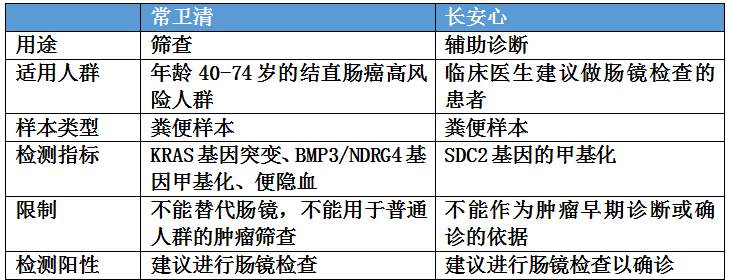
长安心用于肠镜的辅助诊断,也就是为临床医生诊断有疑似肠癌症状的患者提供辅助性证据,发挥鉴别诊断作用,所以既不能单独排除也不能确诊肠癌。我们也同时注意到长安心的临床预期用途里面没有包含进展期腺瘤,显示没有足够数据支持针对癌前病变的检测性能。常卫清则用于40-74岁高风险人群的筛查,这其中包含具备肠癌高风险但是没有临床症状的人群,从中区分健康人和可能患肠癌以及进展期腺瘤的个体,发现隐匿病例,进入后续诊疗流程。
其中,对于常卫清适用高风险人群的判断,《中国结直肠肿瘤早诊筛查策略专家共识》有如下的定义:

二、检验原理
常卫清基于荧光 PCR 技术和胶体金技术,对粪便样本中可能含有的脱落肠道癌变细胞中的变异核酸物质及粪便中可能潜隐的血红蛋白进行检测。
长安心用于体外定性检测人粪便样本中SDC2 基因的甲基化情况。
对于基因甲基化标志物,二者均采用亚硫酸盐处理后对C和U的差异进行检测,在这一点上,我们也期待能早日看到其他方法学的甲基化检测产品上市。
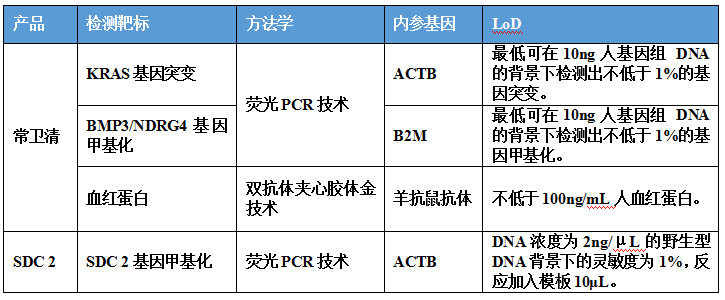
三、分析性能研究
常卫清分析性能评估内容包括准确度(阴/阳性符合率)、精密度、分析灵敏度、分析特异性的研究。便隐血检测部分进行了钩状效应的研究。
常卫清分析性能部分的具体研究方法和结论不再赘述,仅列举与长安心相比值得注意的几点如下:
1.长安心在干扰研究中,发现黄连素(9.23mg/ml)对检测结果有影响,因此提示患者取样前1天应注意勿服用药物黄连素。常卫清也验证了包括黄连素(6mg/g)在内的干扰物质,未发现药物和饮食会对检测结果造成影响;
2.常卫清进行了完整的样本稳定性研究和便型研究,尤其是“布里斯托大便分型规则”,属于新的知识点,有兴趣者可以自行查询;
3.样本的采集和保存方面,常卫清取样5g,在常温下可保存7天;长安心取样1.5~10g,3天内寄送至检测机构。
四、阳性判断值
常卫清阳性判断值的研究采用临床来源粪便样本。共选取628例样本,其中结直肠癌269例、进展期腺瘤64例;非进展期腺瘤24例、肠息肉样本20例、正常人251例。最终根据临床对于检测灵敏度和特异性的需求分析,判定检测综合评分≥165时判断为阳性;综合评分<165时判断为阴性。
因此,该产品的阳性判断值为:
当综合评分≥165时,该样本的检测结果为阳性,当综合评分<165时,该样本的检测结果为阴性。
长安心阳性判断值的研究采用临床来源粪便样本。共选取465例样本,其中结直肠癌患者120例、腺瘤(≥10mm)76例、肠息肉样本(<10mm)31例、肠炎样本24例、胃炎样本6例、胃癌样本18例、胃息肉样本1例,神经内分泌瘤样本3例、肝癌和肠道脂肪瘤样本各1例、正常人184例。
五、临床评价
为了验证常卫清的筛查预期用途,诺辉开展了一项注册临床试验Clear-C,这项研究被称为国内首个癌症早筛人群前瞻性大规模注册临床试验。此前诺辉也在CSCO学术年会上对Clear-C的结果数据做过公开发布,这次审评报告的公开内容又从另一个视角给了我们更多的信息。
以下是这项研究的一些基本信息:
1.受试者人群
结直肠癌高风险人群(高风险人群的判定参照中国结直肠肿瘤早诊筛查相关专家
共识)
2.入组方式
前瞻性入组+回顾性入组
3.比对方法
金标准:肠镜和/或病理检查
4.临床单位
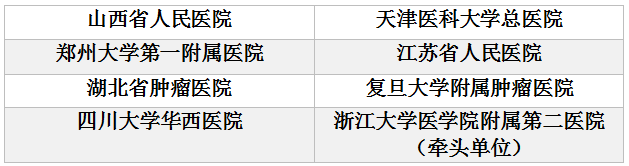
这里值得一提的是临床单位的选择,可以看到很多精心考虑的地方。一是中心数量多,这在目前以注册为目的申请中,很少能见到有产品选择了这么多家中心进行临床试验;二是地域代表性好,临床单位分布于东部、西部和中部,覆盖全国8个省/直辖市;三是有综合性医院,也有肿瘤医院,有不同医疗机构代表性。
整个临床试验按照目的不同,可以分成以下3个部分: